
这篇题为《A Supramolecular Deferoxamine–Crisaborole Nanoparticle Targets Ferroptosis,Inflammation,and Oxidative Stress in the Treatment of Retinal Ischemia/Reperfusion Injury》的研究论文于2025年发表在《Nano Letters》期刊上,由复旦大学和华东师范大学合作完成,通讯作者为复旦大学附属眼耳鼻喉医院的洪佳旭教授和程义云教授。
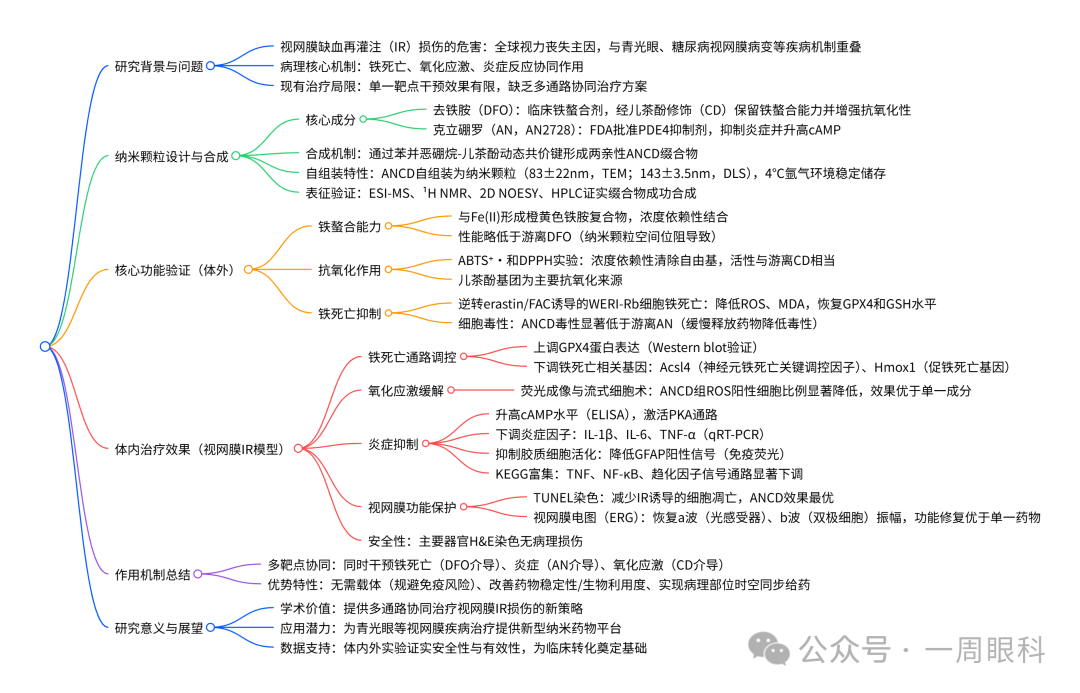
一、研究背景与意义
1.1视网膜缺血/再灌注损伤(IR)
是青光眼、糖尿病视网膜病变、黄斑变性等多种眼病的共同病理基础。
特征:血流中断后再恢复,导致视网膜神经节细胞(RGC)死亡。
三大核心机制:
铁死亡(Ferroptosis):铁依赖性脂质过氧化引起的程序性细胞死亡。
炎症反应:如IL-1β、IL-6、TNF-α等炎症因子大量释放。
氧化应激:ROS(活性氧)水平升高,损伤细胞结构和功能。
1.2现有治疗局限
多数治疗手段只能针对单一机制,效果有限。
药物稳定性差、生物利用度低、难以穿透眼部屏障。
二、研究设计思路
2.1药物选择
Deferoxamine(DFO):铁螯合剂,可抑制铁死亡。
Crisaborole(AN):PDE4抑制剂,具有抗炎作用,可提升cAMP水平,促进RGC存活。
通过**苯氧硼酸-邻苯二酚(benzoxaborole–catechol)**动态共价键连接,形成两亲性分子ANCD,自组装成纳米粒子。
2.2纳米粒子优势
无需载体,避免免疫原性。
同时递送两种药物,协同作用。
增强药物稳定性与靶向性。
三、实验内容与结果分析
3.1纳米粒子构建与表征
成功合成ANCD,并通过质谱、NMR、HPLC等手段验证其结构。
自组装形成稳定纳米粒子,粒径约143 nm,电位-26 mV,10天内稳定性良好。
3.2体外实验(细胞实验)
抗氧化能力:ANCD能有效清除ABTS和DPPH自由基。
抗铁死亡能力:
抑制erastin诱导的脂质过氧化(MDA水平下降)。
提升GPX4蛋白表达(铁死亡关键抑制因子)。
降低ROS水平。
提高细胞存活率。
抗炎作用:
ANCD显著降低IL-1β、IL-6、TNF-α等炎症因子表达。
提升cAMP水平,激活PKA通路。
四、动物实验(小鼠视网膜IR模型)
4.1模型建立
通过升高眼压诱导视网膜缺血,再恢复正常血流,模拟IR损伤。
4.2治疗效果
GPX4表达:ANCD显著上调,抑制铁死亡。
基因表达调控:
下调Acs14、Hmox1等铁死亡相关基因。
RNA-seq分析显示ANCD显著影响铁死亡、TNF、NF-κB等信号通路。
ROS水平:显著下降,抗氧化效果明显。
炎症因子:IL-1β、IL-6、TNF-α等显著下降。
胶质细胞活化(GFAP):ANCD有效抑制胶质细胞过度活化,减轻神经炎症。
视网膜功能恢复(ERG):
a波和b波振幅显著恢复,表明感光细胞和双极细胞功能改善。
细胞凋亡(TUNEL染色):ANCD显著减少视网膜细胞凋亡。
组织安全性:主要器官H&E染色未见明显毒性反应。
五、结论与展望
✅研究结论
ANCD纳米粒子通过同时靶向铁死亡、炎症和氧化应激,实现多通路协同治疗视网膜IR损伤。
在体内外实验中均表现出优异的治疗效果,显著优于单一药物。
安全性良好,无明显毒副作用。
��应用前景
为视网膜缺血性疾病提供一种无载体、多靶点、协同治疗的新策略。
可拓展应用于其他神经退行性疾病(如阿尔茨海默病、帕金森病)中具有铁死亡和炎症机制的疾病。
图1.ANCD纳米粒的构建与功能验证
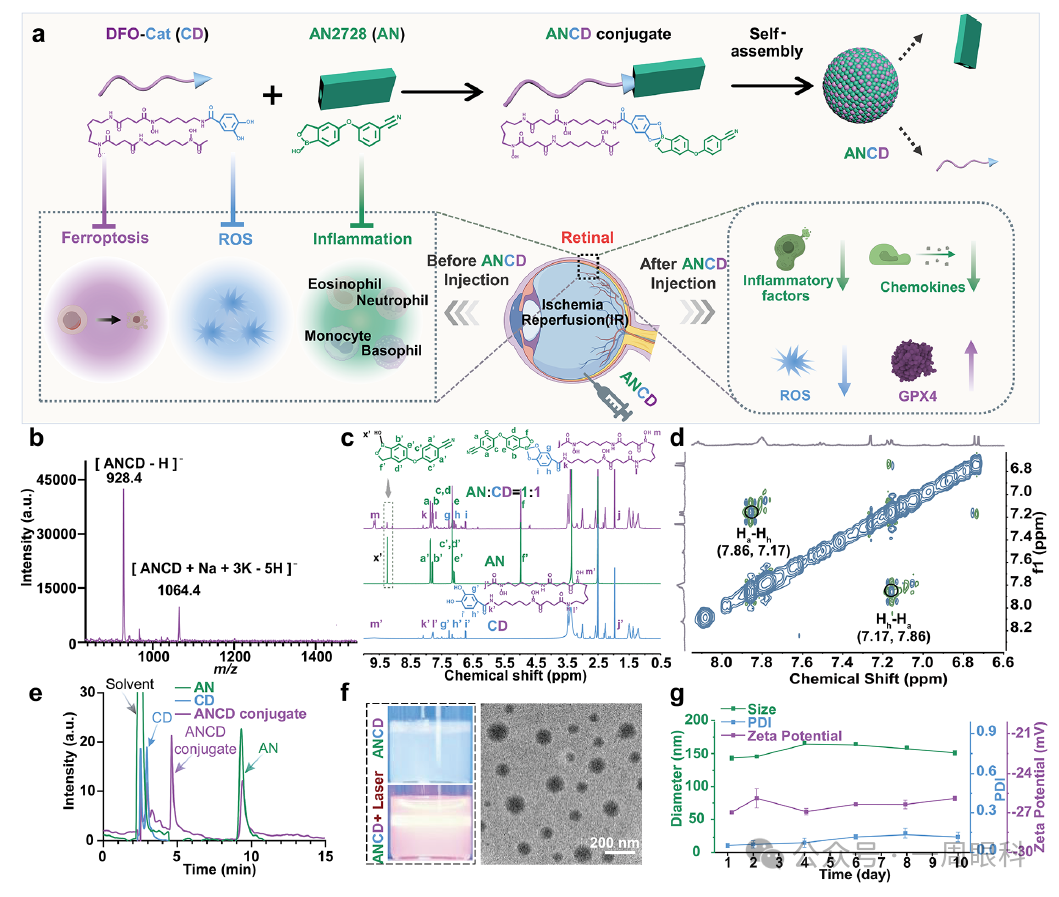
(整图目的:说明ANCD的合成、自组装过程及其在视网膜IR损伤中的多重作用机制)
A.示意图
示意ANCD的合成路线(苯氧硼酸-邻苯二酚动态键连接AN与CD)→两亲性分子自组装成纳米粒→在视网膜缺血/再灌注模型中同时干预铁死亡、ROS与炎症。
B.ESI-MS
电喷雾质谱出现ANCD加合离子峰,证明AN与CD成功形成共价复合物。
C.1H NMR
对比AN、CD及1:1摩尔混合后的AN/CD:AN上B–OH质子峰(9.23 ppm)大幅减弱,提示苯氧硼酸与邻苯二酚已结合成硼酸酯键。
D.2D NOESY
出现AN的Ha(7.86 ppm)与CD的Hh(7.17 ppm)之间的空间相关交叉峰,进一步证实两分子在空间上紧密相邻,形成复合物。
E.HPLC
ANCD在4.6 min出现新峰,与单独AN(9.3 min)和CD(2.9 min)不同,说明生成新共价物种。
F.光学照片与TEM
ANCD胶体可见明显Tyndall效应;TEM显示球形纳米粒,平均直径83±22 nm。
G.DLS跟踪
10天内水合粒径(≈143 nm)、PDI(≈0.02)及ζ电位(≈–26 mV)几乎不变,表明胶体稳定性优异。
图2.ANCD纳米粒的铁螯合、清除ROS与抑制铁死亡能力
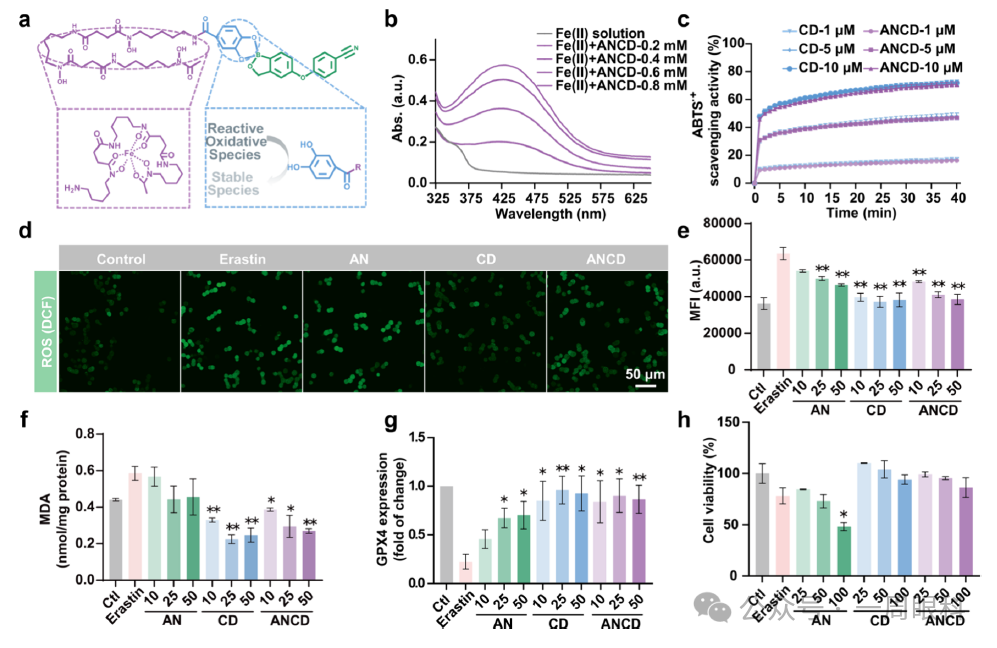
(整图目的:体外验证ANCD保留DFO的铁螯合/抗氧化功能,并抑制经典铁死亡诱导剂erastin的损伤)
A.示意图
CD部分的羟肟酸与邻苯二酚协同螯合Fe³⁺并清除自由基,AN部分提供抗炎作用。
B.紫外-可见光谱
与Fe(II)孵育后,ANCD在420–450 nm出现铁复合物特征吸收,且吸光度随ANCD浓度增加而升高,证明浓度依赖性铁螯合。
C.ABTS•+清除实验
ANCD与游离CD均呈剂量依赖性清除自由基,10µM时清除率近80%,表明ANCD保留抗氧化能力。
D.共聚焦ROS成像
Erastin使WERI-Rb细胞ROS荧光(红色)显著增强;CD或ANCD处理后荧光明显减弱,ANCD效果最佳。
E.流式定量
与D图对应,ANCD使ROS阳性细胞比例降至接近空白对照,显著低于erastin组。
F.MDA含量
Erastin诱导脂质过氧化产物MDA升高;CD与ANCD剂量依赖性降低MDA,AN单药无效。
G.GPX4蛋白水平
Western blot定量:erastin使GPX4下降75%;CD与ANCD显著恢复GPX4表达,AN仅轻微提升。
H.细胞存活率
Erastin造成细胞大量死亡;CD与ANCD显著提高存活率,AN单药无保护作用。
图3.ANCD在视网膜IR损伤中下调铁死亡与氧化应激
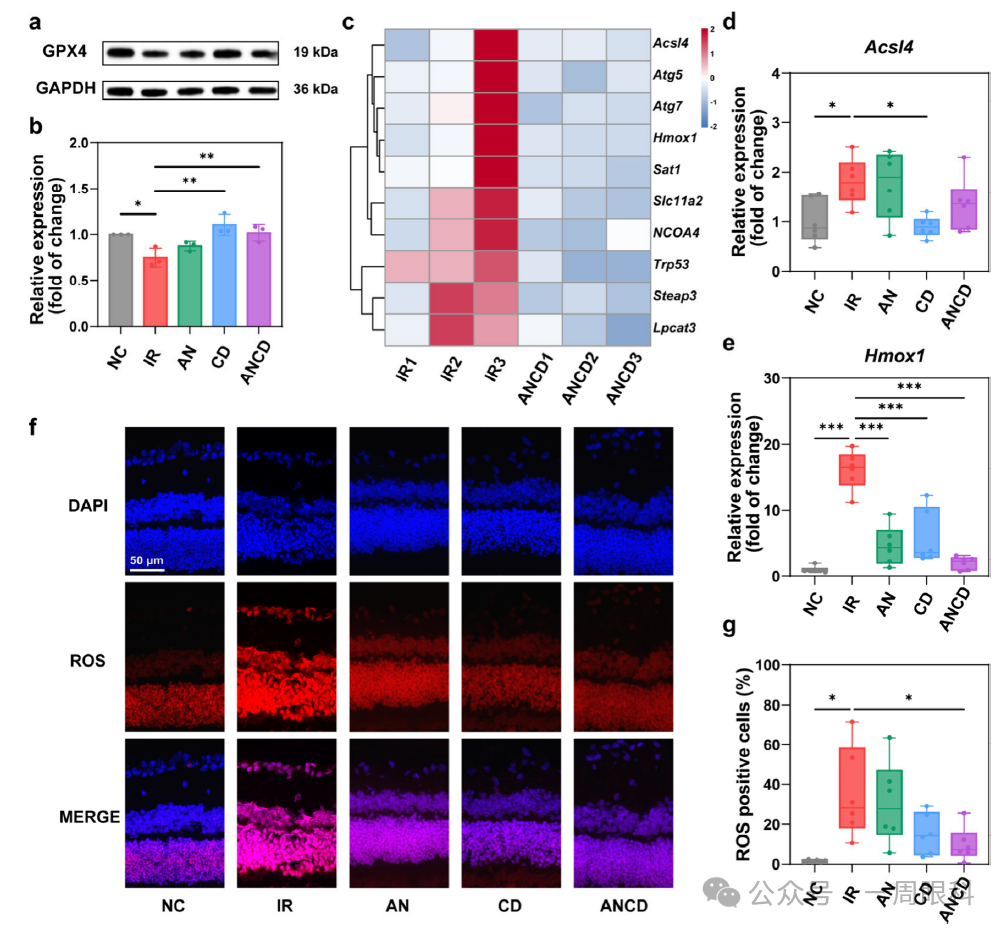
(整图目的:动物水平验证ANCD恢复GPX4、抑制铁死亡基因并减少ROS)
A.Western blot代表图
检测视网膜组织GPX4蛋白:IR组显著下调;CD、ANCD处理后明显回升。
B.定量统计
与A对应,ANCD组的GPX4恢复至接近正常水平,优于单药。
C.热图(RNA-seq)
KEGG铁死亡通路基因:ANCD处理组多数关键基因(Acsl4、Hmox1、NCOA4等)表达下调(蓝色),提示整体抑制铁死亡信号。
D.qRT-PCR–Acsl4
IR升高Acsl4 mRNA;CD、ANCD显著抑制其表达。
E.qRT-PCR–Hmox1
IR升高Hmox1;AN、CD、ANCD均下调,ANCD最明显。
F.冰冻切片ROS荧光
IR后视网膜外核层与内核层红色荧光增强;AN、CD、ANCD依次减弱,ANCD几乎回到背景水平。
G.流式统计ROS阳性细胞百分比
与F对应,ANCD使ROS阳性细胞比例降至与正常对照相当。
图4.ANCD通过抑制PDE4减轻视网膜IR炎症
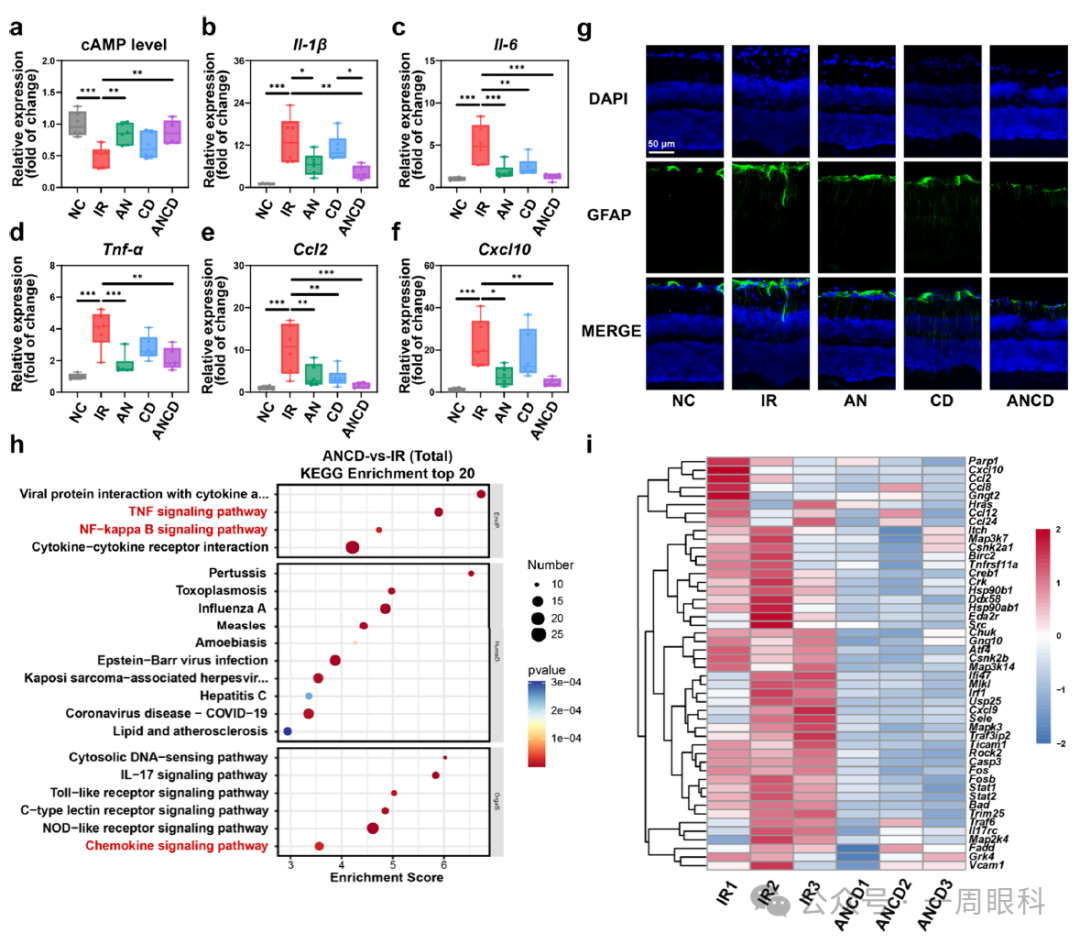
(整图目的:证明AN成分阻断PDE4→升高cAMP→抑制炎症因子及胶质活化)
A.cAMP ELISA
IR组cAMP降低;AN与ANCD处理后显著升高,ANCD略高于AN。
B–F.qRT-PCR炎症因子
Il-1β、Il-6、Tnf-α、Ccl2、Cxcl10在IR组均上调;AN与ANCD显著下调,ANCD效果最佳。
G.免疫荧光–GFAP(星形胶质细胞活化标志)
IR组GFAP绿色荧光增强,表明星形胶质细胞增生;AN、ANCD明显抑制,ANCD几乎回到基线。
H.KEGG富集条形图
ANCD vs IR:显著富集的前20条通路包括TNF信号、NF-κB信号、趋化因子信号等炎症相关通路。
I.热图
TNF、NF-κB、趋化因子三条通路的大部分基因在ANCD组表达下调(蓝色),再次说明ANCD整体抑制炎症级联。
图5.ANCD保护视网膜功能并减少细胞凋亡
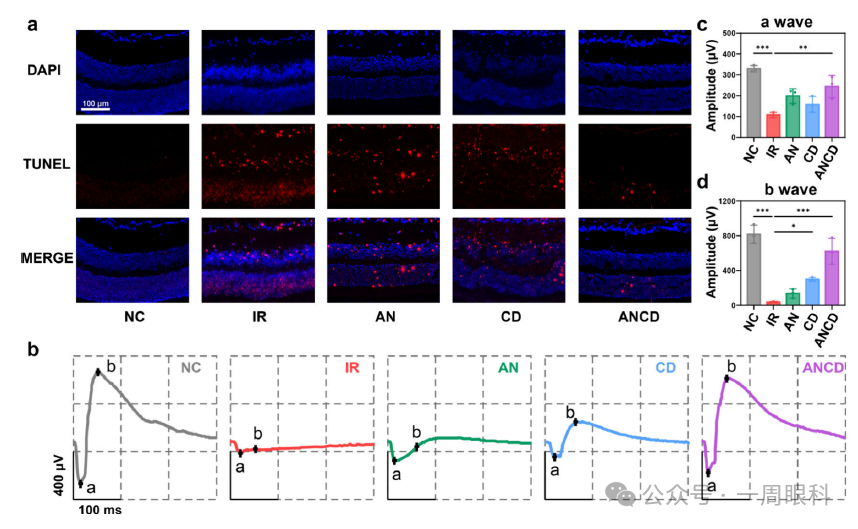
(整图目的:功能学评价——减少细胞凋亡、恢复视网膜电生理)
A.TUNEL染色
IR组外核层与内核层出现大量绿色阳性凋亡核;AN、CD、ANCD依次减少,ANCD几乎无阳性细胞。
B.ERG典型波形
暗适应3.0 cd·s/m²刺激下:IR组a波与b波振幅显著降低;AN、CD、ANCD依次恢复,ANCD波形最接近正常。
C.a波统计
振幅量化:IR下降约60%;ANCD恢复至正常的~85%,显著优于单药。
D.b波统计
趋势与a波一致,ANCD恢复效果最佳。图自文献,侵权删。








