概述
早产儿视网膜病变(ROP)是一种发生于早产儿或低出生体重儿的增殖性视网膜病变,其主要危险因素就是早产和低体重。由于早产儿在出生时视网膜血管尚未完全覆盖视网膜,出生后的血管生长受到氧浓度波动的影响而发生病理改变,轻者可以自行消退,严重时异常的血管生长引起牵拉性视网膜脱离,从而致盲。对早产儿氧饱和度的精准控制可以较好地预防ROP 的发生,但是极低出生胎龄和出生体重会增加早产儿发生ROP 的风险。因此,ROP 在医学进步的当下依然是儿童首位致盲性眼病。
病因和流行病学
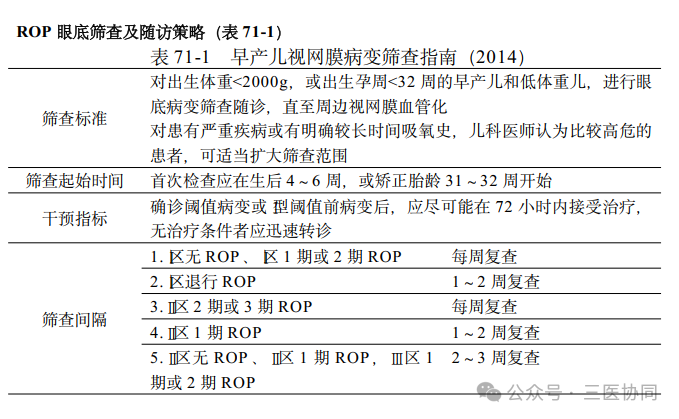
1.危险因素 现在公认的影响ROP 的发病因素主要有胎龄、低出生体重及不规范的高浓度氧疗,故2004 年卫生部颁发的《早产儿治疗用氧和视网膜病变防治指南》中将筛查标准定为出生胎龄≤32 周或出生体重≤2000g 的早产儿和低出生体重儿。
在胚胎发育过程中,视网膜血管化晚期的血管新生阶段包括已有血管发芽形成新生血管以增加中央视网膜毛细血管密度,以及形成周边视网膜深浅层毛细血管丛和视盘周围放射状毛细血管,此过程发生在胎龄 17~40周;24周左右视网膜血管显著增生,32周左右到达鼻侧锯齿缘,出生后才到颞侧锯齿缘。因此,早产儿视网膜周边血管尤其是颞侧血管发育尚未成熟,更易受到损伤,所以认为胎龄是影响ROP发生的重要因素。低出生体重也是影响ROP发病的重要因素,同时极低出生体重儿出生后早期体重增长率是严重ROP的预测因素。而在新生儿治疗中,氧疗是非常重要的部分,但氧疗过程中不规范的吸氧方式及过高的氧浓度和过长的吸氧时间均可能升高ROP的发生率。现在的观点是组织的相对缺氧是引起ROP的重要因素,严格控制吸入氧浓度的波动可以显著降低ROP发生率。除此之外尚有很多研究表明ROP的发生还有很多危险因素,包括妊娠高血压综合征(妊高征)、妊娠糖尿病、遗传、母亲年龄及妊娠期用药、分娩方式、多胎妊娠和辅助生殖技术、遗传因素、婴儿贫血和是否输血、新生儿呼吸窘迫综合征和支气管肺发育不良以及相关药物使用等,均可能与ROP的发生相关。
2.发病机制与流行病学 ROP 的发病与医疗水平密切相关,因此其发病率在不同医疗水平的国家和地区有较大差异。在高收入或发达国家中,ROP 的发病率较为稳定,在出生体重<1500g 的新生儿中分布在12.5%~27.3%,而在中低收入国家中,相应群体中ROP 的发病率分布在30%~50%。
ROP 的发病机制为因早产导致的视网膜及视网膜血管发育停滞,以及因此发生的代偿性异常视网膜血管生长。最终是自然退化还是进展成为视网膜脱离更多取决于早期视网膜血管生长停滞的范围和后期异常血管的增殖程度。在疾病发展过程中,感染、炎症活化和炎症因子以及氧化应激均参与了ROP 的发生。ROP 的第一阶段是由于高氧导致的视网膜血管生长停滞,高氧将下调血管内皮生长因子( vascular endothelial growth factor, VEGF)、促红细胞生成素(erythropoietin, EPO)等氧控血管生长因子,导致视网膜血管生长的停滞,甚至导致已有的视网膜血管退化,大部分患儿随着早产儿状态的好转,各器官系统功能的逐渐完善,停止补充用氧后,ROP 可自行缓解,也就是生理性血管生长的恢复使血管可生长至锯齿缘或近锯齿缘的位置。但是病情严重的患儿则会进入到疾病的第二阶段,也就是当视网膜血管化不足,难以满足日渐增加的视网膜代谢需求时,缺氧导致病理性血管生长和纤维血管膜增殖牵拉。在这个阶段中,VEGF、EPO、IGF-1 等受到缺氧的驱使,诱导血管渗漏性增加,在已血管化的视网膜边缘形成新生血管和纤维增殖,最终导致部分或严重的视网膜脱离。
临床表现
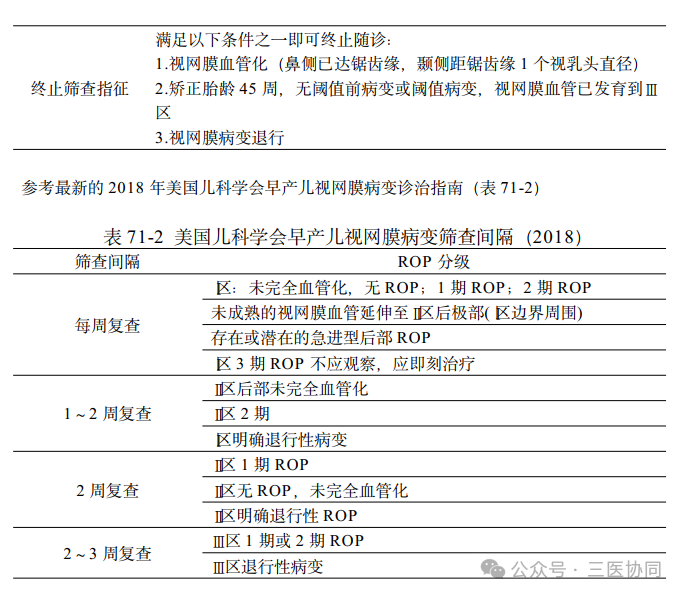
为了能更好地判断病变的发生部位和程度,1984 年制定了ROP 国际分类标准,并于2005 年进行了修订,随着对ROP 检测和治疗方式的改变,2021 年发布了第3 版ROP 国际分类,以便我们能够更好地进行诊断、治疗和随访。依据视网膜中重要结构的位置——视盘和黄斑,通过两个维度即病变范围和严重程度,对ROP 进行了分区和分期,Ⅰ区:以视盘为中心,视盘中心到黄斑中心凹的距离的两倍为半径所画圆圈的区域;Ⅱ区: 以视盘为中心,到鼻侧锯齿缘为半径所画圆圈后除去Ⅰ区的环形区域,颞侧视网膜仅达到赤道部; Ⅲ区:Ⅱ区以外的新月形区域,在第 3 版ROP 国际分类中,将Ⅰ区以外两个视盘直径的环形区域定义为后部Ⅱ区,若病变在此区域内则比其他Ⅱ区内的病变更有恶化的风险。除用病变的分区代表病变的部位、钟点位代表病变的范围外,还根据病变活动程度将ROP 分为急性期和退化期,此外还有象征疾病迅速恶化的附加病变以及代表疾病严重活动的急进性ROP;急性期又依据严重程度分为5 期。
1.急性期
1期:病灶边缘血管生长停止,可在血管化和未血管化视网膜交界面上形成白色、窄的、呈环形的交界线,交界线位于视网膜平面内,在荧光素眼底血管造影(fundus fluorescein angiography,FFA) 中可见到与无血管区交界的末梢视网膜血管分支增多,平行排列,血管盲端呈杵状膨大,伴或不伴轻微荧光素渗漏。
2期:交界区纤维组织增殖,交界线增宽并向玻璃体腔隆起形成嵴,嵴的颜色变化可以从白色到粉红色。此外,在嵴后可出现爆米花样血管异常,此为新生血管形成前改变,血管极度异常并突破视网膜内界膜,可以伴发视网膜出血。由于视盘毛细血管数量的减少,视盘色淡,盘周视网膜血管数量也减少。FFA 显示与无血管区交界的血管末梢分支增多但排列不再整齐,荧光素渗漏明显增加,爆米花样血管团有大量的荧光素渗漏,在有血管区分布的视网膜内可见小片的无灌注区或血管丢失形成的无血管区。
3期:嵴进一步向玻璃体腔延伸,嵴上病理性新生血管生长呈红色,同时伴有纤维增殖,并向嵴后延伸,随着增殖加重形成破布条样改变。有些位于Ⅰ区或者后部Ⅱ区的 3 期病变没有明显的嵴,甚至界限不清,但是根据新生血管的改变依然应该诊断为3 期。FFA 检查中新生血管在早中期就形成严重的荧光素渗漏,同时黄斑区毛细血管扩张渗漏荧光素。
4期:新生血管及纤维组织的增殖牵拉导致部分视网膜脱离,未累及黄斑为4A 期,黄斑脱离则为4B 期,FFA 显示后极部血管弓夹角变窄,黄斑牵拉向颞侧移位,中心凹形态失常,脱离部分视网膜血管数量减少,形成血管投影。
5期:病变进一步恶化导致全视网膜脱离。如不治疗,病变进入4 期以后,通常造成不可逆的视力损害,而 5期病变可致盲。第3版的ROP国际分类将5期病变进一步细化为5A期:开漏斗型视网膜脱离(open-open),即从瞳孔区可以见到视盘;5B期:前开-后闭漏斗型视网膜脱离(open-closed),眼前节结构尚保持正常,视网膜脱离呈闭合漏斗状,视盘不可见;5C期:在5B期的基础上,眼前节结构发生明显异常,如角膜中央变性混浊,前房变浅或消失,晶状体角膜内皮粘连,虹膜后粘连和晶状体前移等,提示闭漏斗型视网膜脱离(closed-closed)。
2.退化期
退化期病变指在患儿的生长过程中病变逐渐消退或消失,最终形成色素改变或遗留下灰白色纤维增殖病灶。FFA 显示近锯齿缘的末梢血管逐渐变细,有轻微渗漏或者形成袢样改变,或因纤维增殖牵拉走行异常。对于退化期的患儿,仍需进行长期的眼底检查和随访。
3.附加病变及急进性早产儿视网膜病变
附加病变:视网膜血管代偿完全失去平衡,发生急性缺氧或突发严重缺氧时出现的后极部视网膜动脉的迂曲和大血管的扩张。FFA 显示动脉极度迂曲,静脉管径明显扩张,黄斑区毛细血管扩张,渗漏荧光素。在部分患儿的虹膜甚至可见新生血管充盈,呈红色改。
急进性早产儿视网膜病变(aggressive ROP ,AROP ):典型特征是快速发展的视网膜新生血管和严重的附加病变。间接检眼镜下或广角眼底照相机下各象限的附加病变表现得尤为突出,动脉极度迂曲,静脉扩张,在血管化视网膜的边界上仅见1~2 支迂曲扩张的静脉血管,迂回呈袢样,即异常的动静脉血管吻合支。FFA 显示后极部血管极度扩张、拥挤,有大量新生血管,荧光素渗漏明显;黄斑结构不清,周边大片未血管化视网膜完全无血管充盈。
辅助检查
1.眼底筛查早期眼底筛查是ROP 诊断、治疗、随访的必要的手段之一,主要通过经验丰富的儿童眼科医师,使用间接检眼镜和/或小儿视网膜成像系统进行眼底检查,较大患儿在可配合的情况下可进行超广角眼底照相检查。
2.荧光素血管造影荧光素眼底血管造影(FFA)在眼底疾病的诊治过程中具有重要的作用,通过FFA 可动态观察视网膜脉络膜血管形态和血液循环状态,同时对婴幼儿眼底病,尤其对ROP 的病理进程、明确诊断和疗效评价具有指导意义。
诊断
ROP 的诊断需综合临床表现和相关病史进行,其临床表现主要包括典型的眼底表现如周边无血管区等,相关病史则包括明确的早产史或低出生体重病史,出生后吸氧史,可无相关家族史。相关辅助检查如FFA 可帮助诊断。
鉴别诊断
常见的需要与ROP 鉴别诊断的疾病包括:
1.家族性渗出性玻璃体视网膜病变(FEVR) FEVR 是一种遗传性视网膜血管发育异常性疾病,遗传方式多样,其主要临床特征包括周边视网膜的血管化不完全和/或视网膜血管分化异常,进而导致各种并发症,其临床表现多样,与ROP 眼底表现类似,但缺乏早产史和出生后吸氧史等相关病史。
2.外层渗出性视网膜病变(Coats 病) 是一种儿童多见的视网膜血管性疾病,通常表现为视网膜毛细血管扩张和动脉瘤性视网膜血管病变,伴有视网膜层间及视网膜下渗出,病情严重时会导致渗出性视网膜脱离。但患儿多无与ROP 相关的早产和吸氧史,同时本病多为单眼发病,需与ROP 鉴别。
3.永存原始玻璃体增生症(PHPV) 是一种先天性眼部发育异常,为胚胎期原始玻璃体未能正常退化所致。PHPV 患者多因白瞳、斜视、小眼球等就诊,在出现白瞳时需与ROP 进行鉴别,PHPV 患儿可无早产吸氧史,单眼常见,对侧眼基本完全正常,可有睫状突拉长的特征性表现。
4.视网膜母细胞瘤(RB) 是婴幼儿最常见的恶性肿瘤,其首诊症状多为白瞳症,故当ROP 引起视网膜脱离造成白瞳症时可与之发生混淆。而ROP 主要发生于早产儿或低出生体重儿,常常是双眼发病,散瞳后眼底检查可见视网膜血管形态异常伴增殖性病变,可伴有渗出性视网膜脱离,但无肿瘤占位等病灶,同时详细询问病史及家族史可与之鉴别。
5.其他可引起白瞳症表现的眼部疾病 白瞳症(leukemia)指自然光线照射下,儿童瞳孔区出现异常白色或黄白色反光的眼部体征,可能导致白瞳的疾病有很多,严重的ROP 可导致患儿视网膜脱离,出现白瞳的表现,故其他可引起白瞳的疾病同样需与之鉴别,包括牵牛花综合征、眼组织缺损和眼白化病等。
治疗
1.非增殖性的 ROP一般自行消退,无须治疗,但是依然会导致一定程度的视功能损害,如近视、弱视等,需进行长期随访。
2.冷冻治疗 早期治疗ROP 所采取的巩膜冷冻疗法,长期随访证实治疗阈值期ROP病变可以挽救视力,但副作用较重,且与激光治疗相比,对周边视野的损害严重,且疗效并不优于激光治疗,因此已很少使用,仅可能在屈光间质混浊或玻璃体积血,以及难以看清周边视网膜时用到。
3.激光治疗 激光治疗逐渐替代了冷冻治疗,但治疗适应证依然沿用阈值期的标准,相关的并发症有球结膜水肿、出血、撕裂、视网膜中央动脉阻塞、视网膜出血、玻璃体积血、眼前段缺血等。
4.抗血管内皮生长因子药物治疗 抗VEGF 的生物制剂用于临床始于2004 年,可用于眼底新生血管性疾病以消退病理性新生血管生长,同时可以带来生理性视网膜血管新生的恢复,不同于以往的冷冻和激光治疗带来的周边视网膜和血管结构的永久性破坏,抗VEGF 药物治疗并不会形成视网膜结构的破坏,提供了保留视网膜、减少视功能破坏的可能。主要药物包括雷珠单抗、康柏西普、阿柏西普等,同时目前与药物相关的全身不良反应尚不明确,还需要长期随访结果。
5.手术治疗 对于4 期以上的ROP 患儿需采取手术治疗,包括巩膜外环扎、垫压或者玻璃体切割手术分别从外向内或从内向外缓解视网膜牵拉。当病变进展至5 期时,经过手术尽可能地去除玻璃体,达成部分视网膜的复位可以恢复部分视力,维持眼球形态。
预后
目前ROP 患儿中经冷冻治疗及激光光凝者因这两种方法均通过破坏周边部视网膜无血管区达到使视网膜新生血管退行的目的,所以部分患儿远期会出现视野丧失和明显的早发近视。而抗VEGF 药物治疗的远期并发症较少,且一次治愈率较高(大于90%),只要早期及时治疗,病变逆转的概率很大,但仍需长期规律的屈光筛查如定期验光,以便于及时发现弱视并治疗,如规律的弱视训练等。
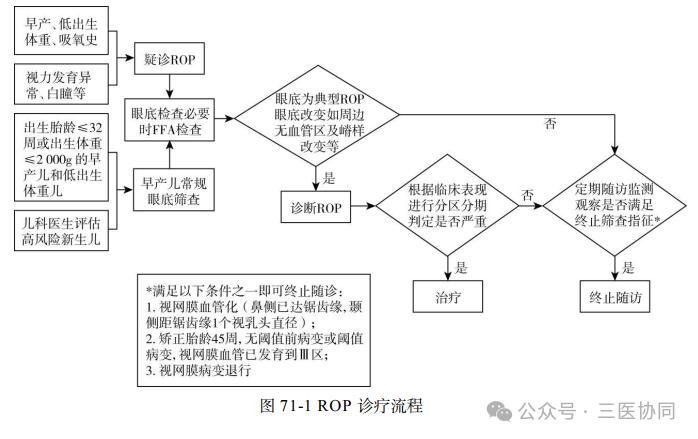
诊疗流程(图71-1)
参考文献:略








