一、前言
眼睛作为人类最重要的感觉器官,承载着超过 80% 的外部信息感知功能。然而,全球范围内超过 22 亿人遭受眼疾困扰,其中玻璃体视网膜疾病更是导致失明的首要原因之一。玻璃体视网膜手术因眼内结构复杂、手术空间极度有限,对器械精度和操作稳定性提出了苛刻要求,传统手动手术已难以满足临床治疗的精准需求。视网膜下基因治疗等新兴技术的发展,使得视网膜下注射、血管插管等微侵袭操作成为治疗关键,但视网膜色素上皮仅 25 微米的厚度、血管直径小于 150 微米的解剖特征,已超出人类手动操作的生理极限 —— 手部自然震颤、肌肉抽搐等因素常导致超过 100 微米的操作偏差。
机器人辅助手术技术通过运动缩放、震颤抑制等优势,为眼科手术带来了新的解决方案。目前已出现鲁汶大学协作机器人系统、PRECEYES等多个眼科手术机器人平台,部分已进入早期人体临床评估阶段。但现有系统仍存在明显局限:多数依赖遥操作模式,外科医生需同时协调器械三维位置与方向,学习曲线陡峭且手术一致性受操作者经验影响显著;眼内环境感知受限,传统显微镜视野狭窄,OCT 技术虽能提供高分辨率横截面图像,但存在视野局限和横向整合不足等问题;器械深度定位精度不足,现有运动学推断、投影估计等方法难以应对视网膜不规则性和复杂手术环境的挑战。
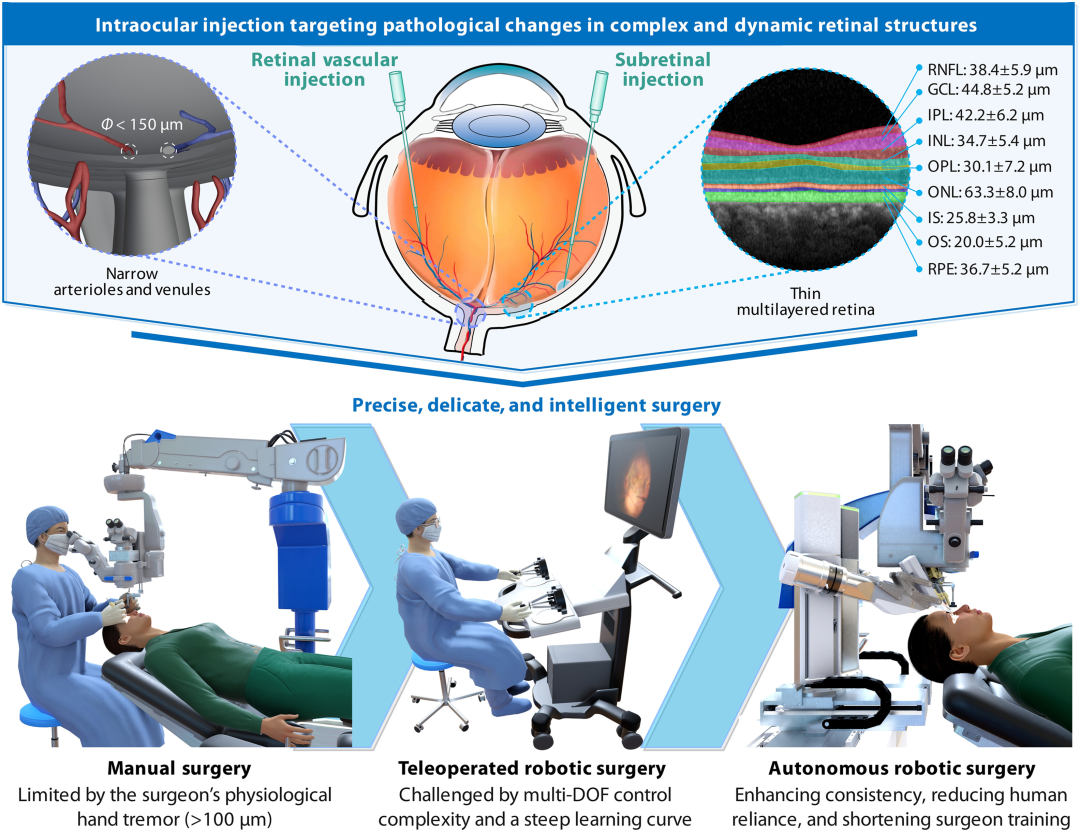
图1:眼内结构及眼内手术操作技术的演变。眼内结构复杂,需要精准、精细且智能的手术方法。随着治疗技术的进步,手动和远程机器人手术已无法完全满足临床需求。自主机器人手术能够提高手术一致性,提升患者安全性,减少对人力资源的依赖,并最大限度地减少人为错误,从而支持更安全、更可靠的治疗。
手术机器人的自主性被视为显微手术领域的核心发展方向。自主系统通过闭环感知、规划与控制,有望突破人为操作局限,实现手术精度、一致性和安全性的全面提升。针对眼科手术自主性不足的行业痛点,来自中国科学院自动化研究所多模态人工智能系统全国重点实验室 边桂彬研究员团队联合多领域研究者开发了自主眼内手术机器人系统(ARISE),在《Science Robotics》(《科学・机器人》)2026 年 1 月 14 日刊发表的研究中,首次实现了眼内空间的完全自主靶向视网膜注射,为玻璃体视网膜疾病治疗提供了革命性技术方案。本文将从技术创新、实验验证、临床价值与未来展望等方面,对该研究进行深度解析。
二、核心技术创新
ARISE 系统的设计与突破
2.1 系统整体架构
ARISE 系统由高精度双机械臂显微手术机器人、三维术中导航系统及人机协同的力 - 位置 - 成像混合安全控制模块构成(图 2),通过多技术融合实现从术前规划到术中执行的全流程自主操作。
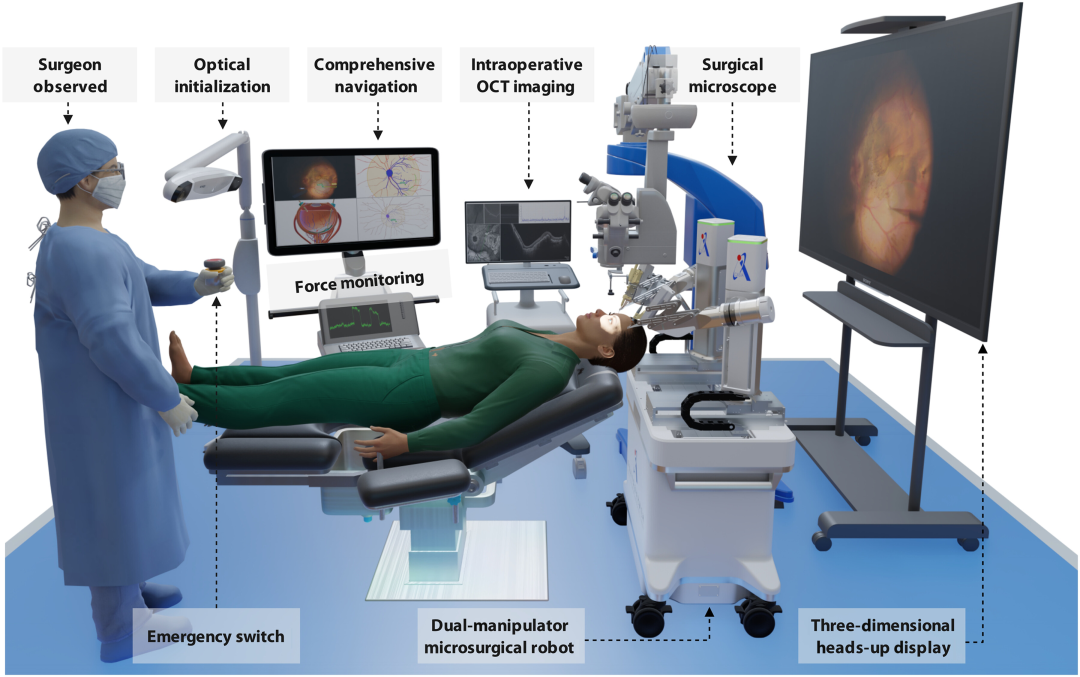
图2:眼内手术自主机器人系统 (ARISE)。高精度、灵巧的双机械臂显微外科手术机器人可在术中 3D 导航引导下进行自主视网膜注射,该手术在人眼观察的力-位置-成像混合安全控制下进行。
ARISE 系统核心设计理念源于人类双手协同工作模式,采用双机械臂配置:右侧机械臂握持集成力传感、距离传感功能的定制注射针,左侧机械臂操控医用光纤提供眼内照明(图 3A)。该配置通过共享基准坐标减少空间校准误差,12 个自由度的运动设计使其工作空间覆盖人类头部周围操作区域,运动中心(RCM)定位于巩膜套管针插入部位,重复定位精度达 7 微米,针尖运动控制分辨率 0.5 微米,力灵敏度 2 毫牛,完全满足眼内微米级操作需求
值得关注的是,ARISE 系统中用于深度定位的 A-scan 技术已经精准契合当前靶向注射需求,但随着眼科精准医疗的发展,临床对局部组织结构的全面性认知提出了更高要求 —— 三维扫描技术有望进一步解锁复杂眼内环境的细节呈现,为手术规划与风险预判提供更丰富的决策依据。目前,已有科研团队成功研发出具备微米级分辨率的三维成像iOCT probe,并且做了成像深度提升以更好应对呼吸、心率对成像质量的影响,若相关企业、科研机构有意开展联合研发、产品集成(眼科手术平台、机器人系统)或临床转化合作,可通过青白视角后台留言,我们将协助搭建沟通桥梁,促进前沿技术与产业需求的高效对接。
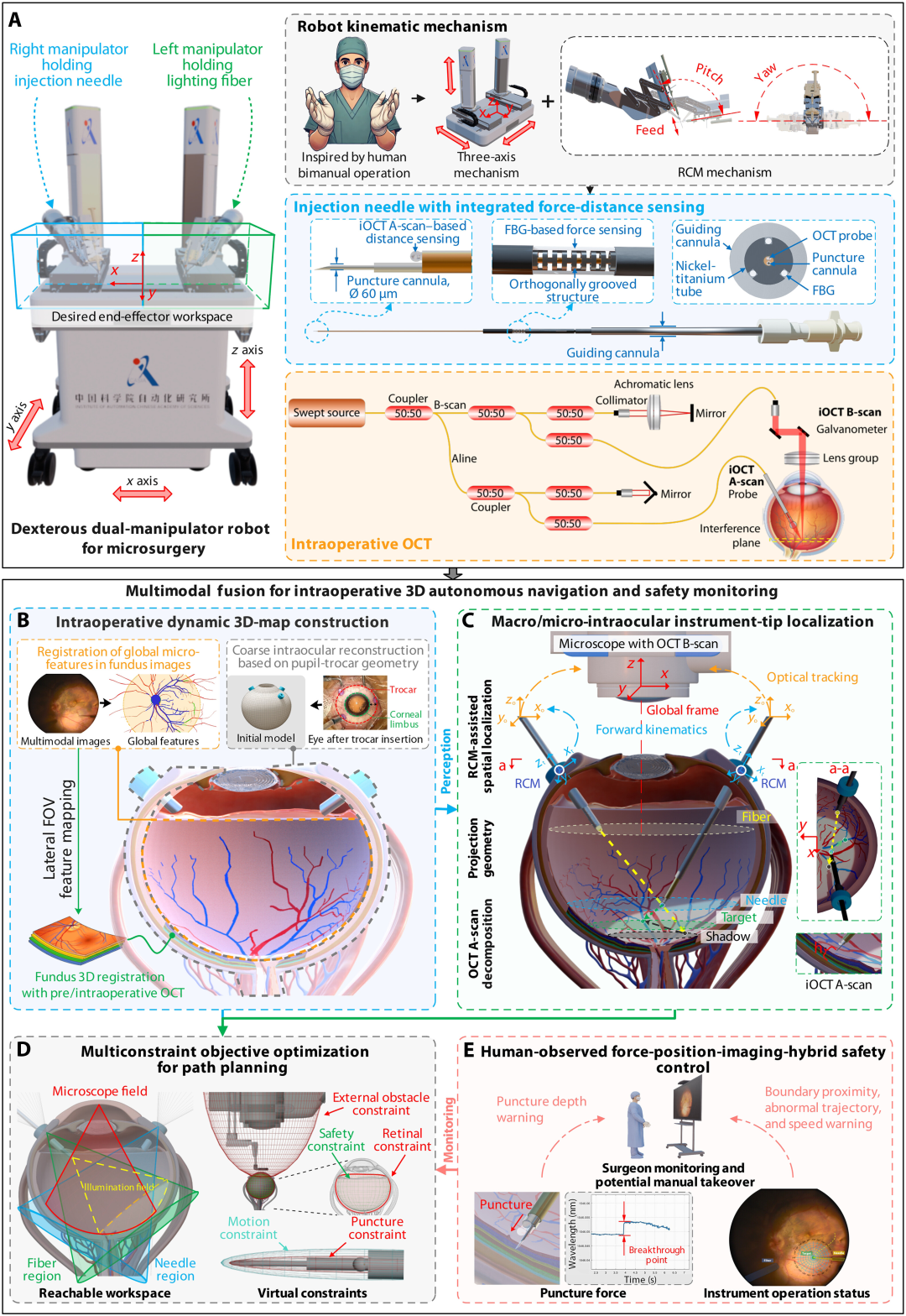
图3.:ARISE 的组成部分。(A)该显微外科机器人采用双机械臂结构,具有12个自由度,其设计灵感源于人类的双手操作。左侧机械臂握持照明光纤,右侧机械臂握持定制开发的注射针,该注射针针尖直径仅为60 μm,并集成了基于OCT A扫描的距离传感和微力传感技术。(B)通过整合术前和术中来自横向和轴向视野的数据,利用多视角空间融合技术,在术中为每只眼睛构建个性化的动态全局3D地图。(C)利用该全局地图,通过多传感器数据的加权融合,实现了从眼前节到视网膜底的分层器械姿态感知,并建立了眼内环境的交互模型。(D)通过整合来自RCM、显微镜视野、照明几何形状、组织保护边界和器械运动限制的约束条件,多重约束条件划定了障碍区域和安全操作区域,形成了一个全局配置空间,用于支持路径规划。椭球建模降低了计算复杂度,并有助于安全、精确地生成注射轨迹。( E ) 人眼观察的力-位置-成像混合安全控制模块动态评估器械与组织的相互作用,实时监测穿刺事件,限制穿刺深度,并支持机器人控制和手动控制之间的无缝切换。
2.2 眼内环境感知技术:多视角空间融合
针对多模态眼内成像的异质性和动态空间错位问题,研究团队提出多视角空间融合技术,构建动态三维眼内地图(图 3B)。该技术通过两个协同模块实现突破:一是交互式空间对齐模块,整合局部 - 全局空间转换器与真实性预测器,基于瞳孔 - 套管针几何结构重建、眼底全局微特征配准、横向视野特征映射三维配准等算法,实现多源图像的时空对齐;二是跨模态偏移预测模块,通过实例感知适配器跟踪局部位移,基于几何关系和匹配矩阵预测全局偏移。通过 PRTransUNet 分割多模态图像特征并分配置信权重,该技术有效降低了对显微镜图像质量的敏感性,弥补了单模态方法的检测盲区,为自主导航提供了稳定的环境感知基础。
2.3 器械定位技术:多传感器准则加权融合
为解决不同传感器在检测范围、误差大小和采样频率上的差异,研究提出多传感器数据准则加权融合方法,实现器械尖端的宏 / 微精度定位(图 3C)。该方法包含两个关键步骤:多源数据归一化通过共同目标配准和多频率插值,对齐宏观(光学跟踪、机器人运动学)与微观(iOCT A/B 扫描)定位算法输出;多准则证据源融合采用最佳 - 最差法,基于定位精度、响应速度、稳定性和鲁棒性四个准则计算权重,生成最终定位结果。通过分层器械姿态感知,该技术实现了从眼前段到眼底的全区域精确跟踪,支持复杂眼内环境中的实时交互与动态调整。
2.4 安全控制与路径规划
ARISE 系统通过多约束目标优化实现安全路径规划(图 3D),整合运动中心(RCM)、显微镜视野、组织保护边界等约束条件,划定障碍区域与安全操作区域,采用椭球建模降低计算复杂度,基于改进快速探索随机树算法生成安全、高效的注射轨迹。人机协同的力 - 位 - 像混合安全控制模块(图 3E)动态评估器械与组织相互作用,通过低延迟力传感检测穿刺事件,限制穿刺深度,并支持机器人与手动控制的无缝切换,有效应对术中突发情况,保障手术安全。
三、实验验证
从模型到在体的全面评估
3.1 实验设计与流程:三级验证三个场景三个阶段
研究团队通过三级实验验证 ARISE 系统的有效性:眼球模型(静态环境)、离体猪眼(半静态环境)、在体动物眼(动态生理环境),覆盖视网膜下注射、视网膜中央静脉(CRV)注射、视网膜分支静脉(BRV)注射三种临床关键操作。自主手术流程分为三个阶段:术前准备(眼部数据采集、器械遥操作插入、目标选择)、目标定位(器械视野进入、运动校准、精细对齐)、穿刺注射(自主穿刺、药物输送、安全撤离),后两个阶段完全由机器人自主执行(图 4)。
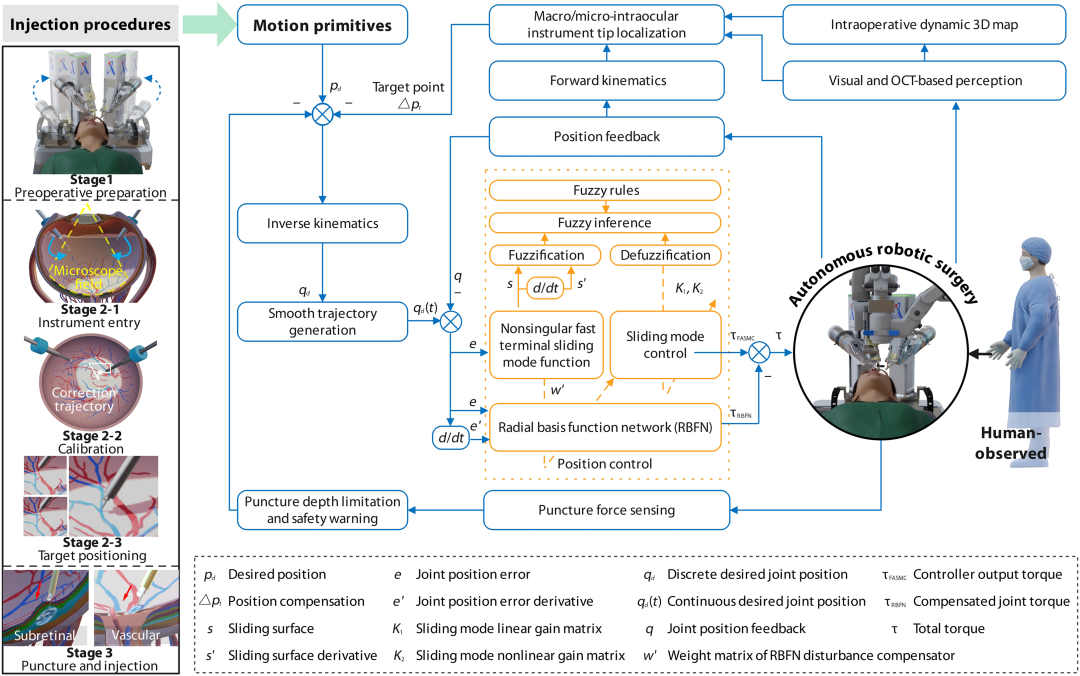
图4.:ARISE 的手术流程和统一控制架构。该手术流程分为三个主要阶段。第一阶段包括眼部数据采集和双机械臂器械的远程操控插入。第二阶段,ARISE系统自主完成目标定位、运动校准和定位。第三阶段自主执行视网膜穿刺,用于视网膜下或血管内注射。整个手术流程由统一的控制架构控制。通过任务分解生成特定任务的运动基元,并利用逆运动学、轨迹平滑和基于径向基函数网络的模糊自适应滑模控制闭环控制器来执行。动态三维映射、宏观/微观协同定位以及对器械运动和穿刺力的实时监测,确保了整个流程的准确性和安全性。
3.2 眼球模型实验结果
采用模拟人类视网膜血管系统的硅胶眼球模型(120 个,含 8 种临床视网膜图案)进行测试,平均定位误差 x 轴 15.39 微米、y 轴 15.59 微米、z 轴 3.92 微米,最大误差均小于 50 微米(图 5D)。整个自主工作流程平均耗时 154.81 秒,其中校准阶段耗时最长,黄斑区(区域 2)操作速度最快,验证了系统在静态环境下的高精度定位能力和流程效率。
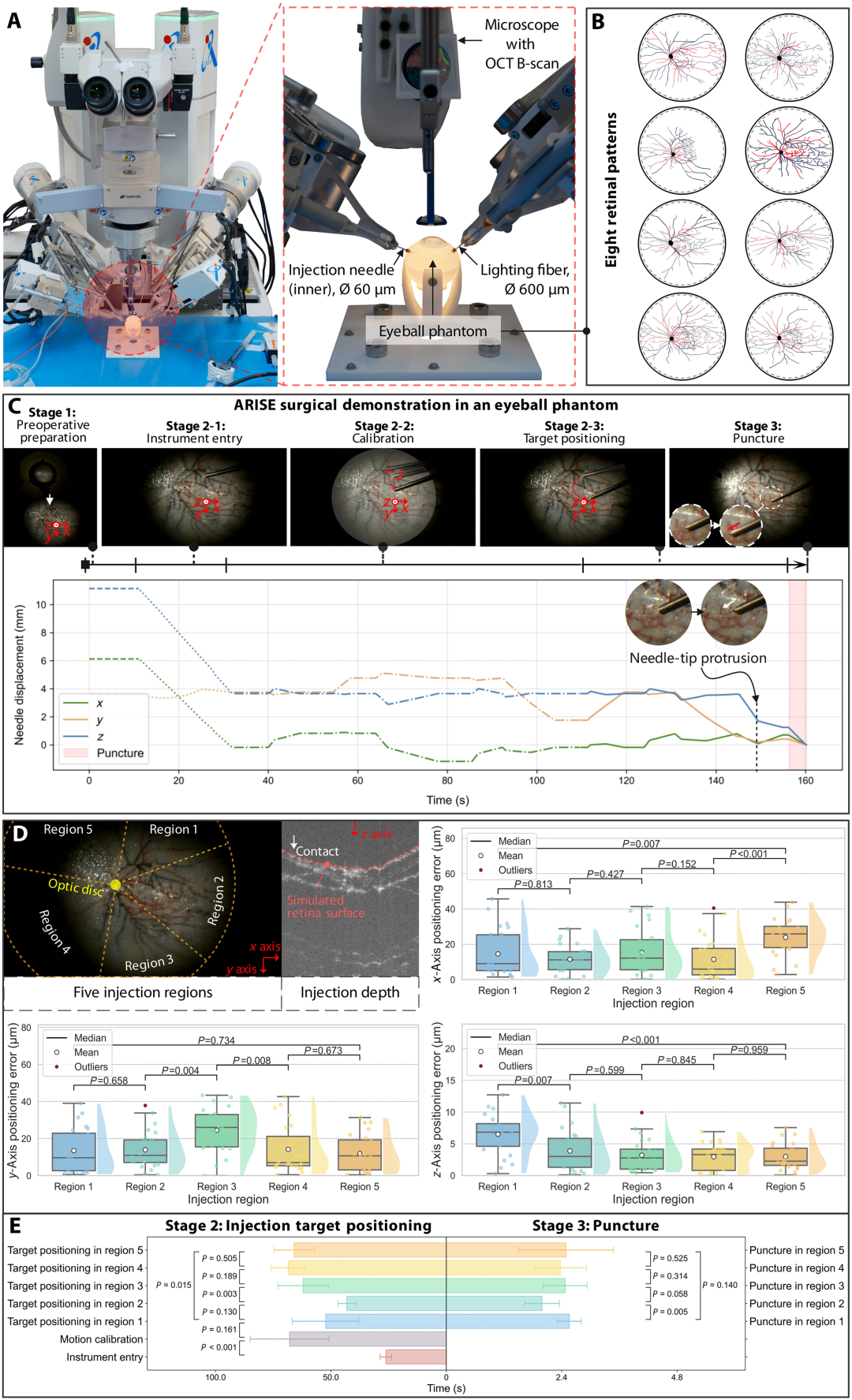
图5:使用眼球模型进行自主注射定位的结果。由于缺乏生理运动和眼内循环,所有实验均在静态眼内条件下进行。( A ) 实验装置。( B ) 八种视网膜图案,包括视盘和血管。( C ) ARISE 执行的典型眼内工作流程。( D ) 注射靶向、穿刺深度定义和定位误差分布的区域划分。( E ) 自主工作流程各阶段所需时间。
3.3 离体猪眼实验结果
在半静态环境下(局部组织变形、玻璃体扰动),ARISE 系统实现 100% 注射成功率(每种注射类型 n=20,95% 置信区间 83.2%-100.0%)。视网膜下注射后可见明显视网膜隆起,血管注射后观察到特征性血液流动模式(图 6B)。定位精度保持优异:视网膜下注射 x 轴 16.29 微米、y 轴 14.25 微米、z 轴 12.52 微米;CRV 注射 x 轴 16.72 微米、y 轴 11.39 微米、z 轴 3.27 微米;BRV 注射 x 轴 17.89 微米、y 轴 13.78 微米、z 轴 7.28 微米(图 6D)。平均手术耗时 188.83 秒,略长于眼球模型,主要因猪眼视网膜特征分散导致计算时间增加。
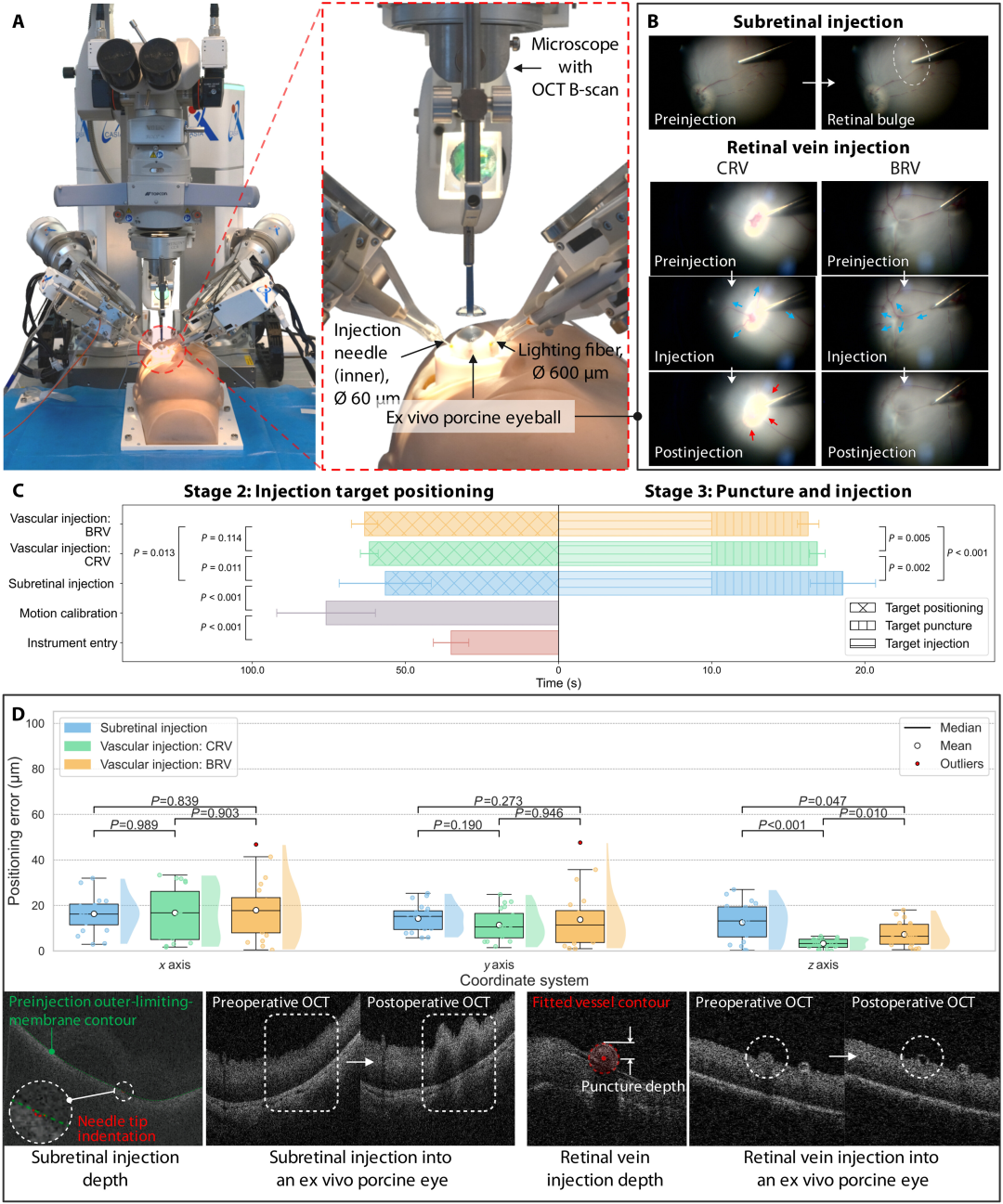
图6:体外猪眼球自主注射的结果。所有实验均在半静态眼内条件下进行,其特点是局部组织变形、玻璃体扰动,且无呼吸或血流等生理运动。( A ) 实验装置。( B ) 视网膜下和视网膜静脉注射的结果。( C ) 自主工作流程各阶段所需时间。( D ) 注射前后定位误差、穿刺深度以及iOCT对比。
3.4 在体动物眼实验结果
在巴马小型猪(12 只)和新西兰白兔(4 只)的动态生理环境下(呼吸运动、血流脉冲),系统仍保持 100% 成功率(每种注射类型 n=16,95% 置信区间 79.4%-100.0%)。视网膜下注射产生典型隆起,血管注射后观察到血管重新充盈现象(图 7B)。定位误差表现稳定:视网膜下注射 x 轴 16.58 微米、y 轴 12.65 微米、z 轴 9.30 微米;CRV 注射 x 轴 17.44 微米、y 轴 10.26 微米、z 轴 4.68 微米;BRV 注射 x 轴 19.56 微米、y 轴 10.33 微米、z 轴 6.22 微米(图 7D)。平均手术耗时 194.38 秒,术中未出现出血、视网膜撕裂等并发症,术后 1 周随访无视力障碍、眼混浊等异常,验证了系统的临床安全性和微创性。
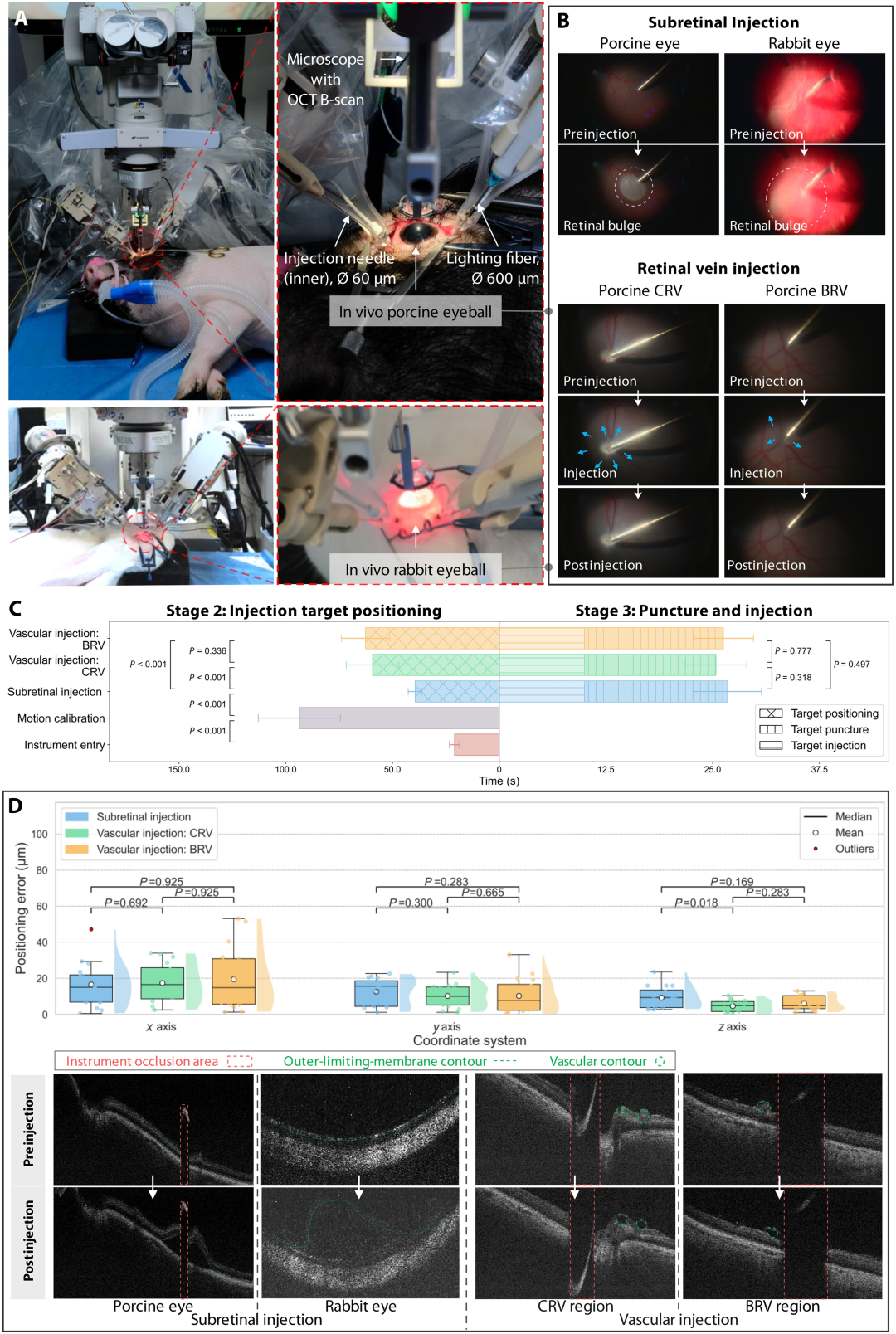
图7:活体动物眼球自主注射的结果。所有实验均在完全动态的眼内条件下进行,包括呼吸和血流等生理运动。( A ) 实验装置。( B ) 视网膜下和视网膜静脉注射的结果。( C ) 自主工作流程各阶段所需时间。( D ) 注射前后定位误差、穿刺深度以及iOCT对比。
3.5 与传统手术方式的对比
在离体猪眼上进行的对比实验显示,ARISE 系统在定位精度、运动稳定性和一致性方面显著优于手动手术和遥操作手术(图 8)。定位误差方面,自主手术平均误差 11.71 微米,较手动手术(58.17 微米)降低 79.87%,较遥操作手术(25.80 微米)降低 54.61%;运动轨迹分析表明,自主手术波动最小、速度恒定,手动手术因手部震颤抖动明显,遥操作手术存在阶段性停顿;成功率方面,自主手术和遥操作手术均达 100%,手动手术因震颤导致 BRV 注射成功率下降;手术时间上,自主手术虽较手动手术多耗时 56.68 秒,但相对于临床常规手术总时长仍在可接受范围。
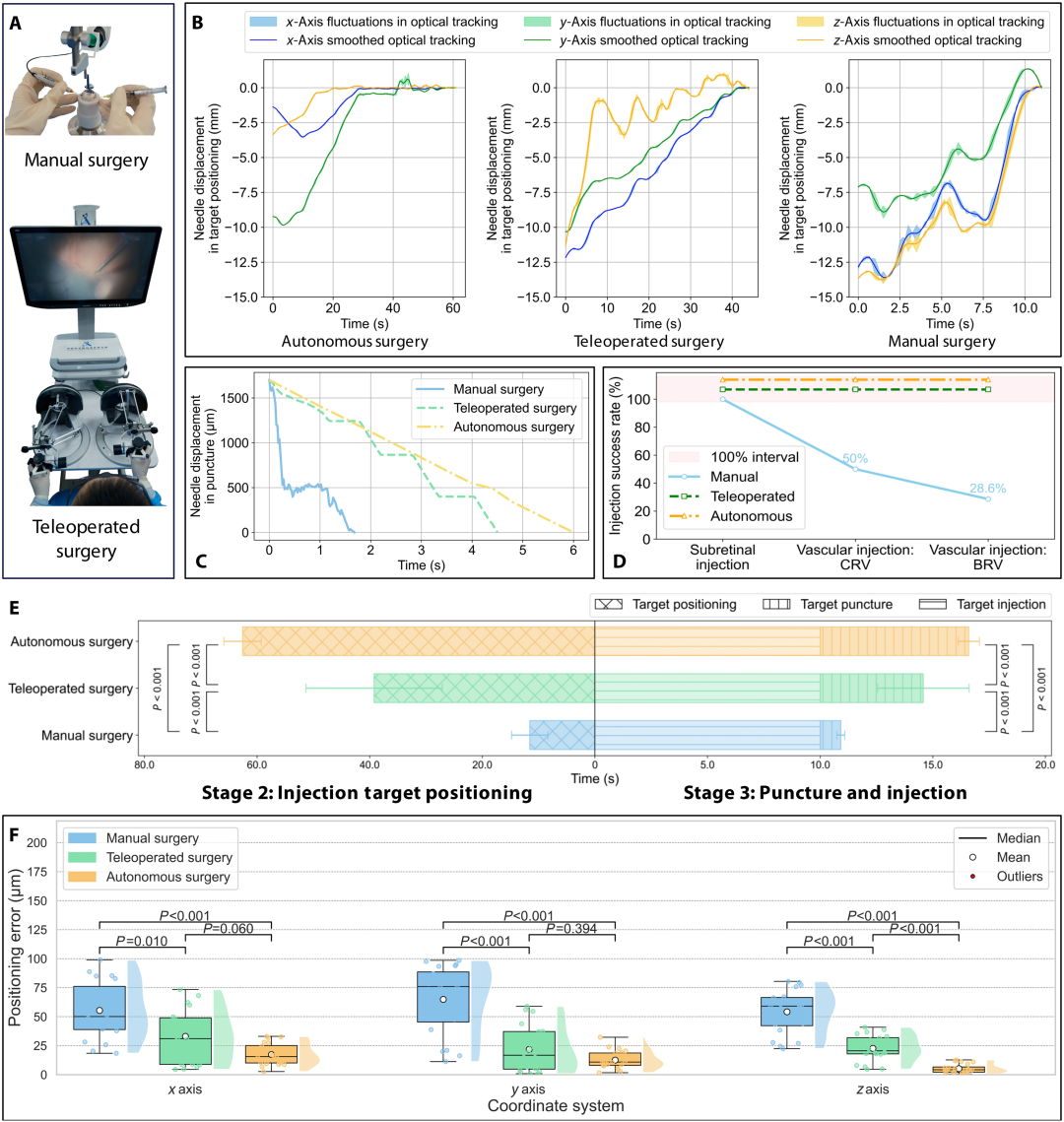
图8:体外猪眼球自主手术、手动手术和远程手术的比较。(A)实验装置。(B)目标定位过程中注射针尖的运动轨迹。(C)相同穿刺距离下运动轨迹的比较。(D)注射成功率。(E)同一手术阶段耗时比较。(F)自主手术、远程操作手术和手动手术中定位误差的比较。
四、临床价值与行业影响
4.1 技术层面的突破性意义
ARISE 系统的研发成功实现了眼科手术自主性的跨越式发展,其核心突破体现在三个方面:一是首次构建了覆盖眼内全空间的自主手术能力,突破了现有系统仅能实现部分子任务自动化的局限;二是通过多模态融合技术解决了眼内环境感知难题,动态三维地图构建技术为复杂显微手术提供了新的感知范式;三是宏/微结合的定位方法将器械定位精度提升至微米级,为高精度医疗操作树立了新标杆。这些技术创新不仅适用于视网膜注射,更可为其他显微手术(如神经外科、耳鼻喉科微创手术)提供技术借鉴。
4.2 临床应用的核心价值
提升手术安全性与有效性:100% 的注射成功率和显著降低的定位误差,有效减少了术中并发症风险,为视网膜基因治疗等精准医疗技术的临床转化提供了保障。
提高手术一致性:自主系统摆脱了对医生经验的依赖,有效降低操作者个体差异带来的手术效果波动,有助于标准化治疗方案的推广。
降低医疗资源门槛:自动化流程缩短了手术医生培训周期,减少了对高级专业人才的依赖,有望使高精度视网膜手术向基层医疗机构延伸,惠及更多偏远地区患者。
拓展手术应用场景:系统在动态生理环境下的稳定表现,为极端环境下的医疗救援、长期太空探索中的医疗保障等特殊场景提供了可能。
4.3 与现有技术的对比优势
相较于已有的眼科手术机器人平台,ARISE 系统具有三大核心优势:一是自主性更强,实现了从定位到注射的全流程自主,无需医生实时操控;二是集成度更高,融合多模态感知、高精度控制、安全监测等功能于一体,系统兼容性和协同性更优;三是适应性更广,在模型、离体和在体环境中均表现出稳定性能,且覆盖多种注射类型,临床应用场景更丰富。目前 PRECEYES 等系统虽已进入临床评估,但仍以遥控操作为主,ARISE 的技术路线为眼科手术机器人的发展指明了新方向。
五、挑战与未来展望
5.1 当前面临的主要挑战
尽管 ARISE 系统表现出优异的实验性能,但临床转化仍面临多重挑战:一是系统通用性有待验证,现有研究主要基于健康动物模型,在病理状态(如视网膜变性、增生性病变)下的适应性仍需评估;二是生理运动补偿需进一步优化,呼吸、心跳等引起的微米级眼动虽未影响实验结果,但在长时间复杂手术中的累积效应可能影响精度;三是监管与伦理问题,自主手术系统的决策权转移对临床验证、责任界定等提出了新的监管要求;四是标准化与产业化难题,需建立统一的性能评估标准,优化系统可靠性和成本控制,以满足临床规模化应用需求。
5.2 未来发展方向
技术迭代优化:进一步提升系统对病理环境的适应性,开发基于 AI 的实时组织形变补偿算法,增强系统在复杂临床场景中的鲁棒性;优化硬件设计,实现系统小型化、轻量化,提高临床适用性。
拓展应用范围:将自主技术拓展至玻璃体切割、视网膜脱离修复等更多眼科手术类型,探索在神经外科、心血管介入等其他显微手术领域的应用。
临床转化推进:开展多中心临床研究,建立长期随访数据库,系统评估手术的长期安全性和有效性;与监管机构密切合作,建立自主手术机器人的临床验证标准和伦理规范。
多学科协同创新:加强医学、工程学、计算机科学等多学科交叉合作,推动手术机器人与人工智能、大数据等技术的深度融合,构建智能化、个性化的精准医疗体系。
结论
自主眼内手术机器人系统(ARISE)的研发成功,虽然目前尚处于试验级设备阶段,但标志着眼科手术进入全自主时代。该系统通过多视角空间融合、多传感器准则加权融合等核心技术创新,实现了靶向视网膜注射的高精度、高成功率自主执行,在静态模型、离体组织和在体动物实验中均表现出优异性能,定位精度较传统手动手术和遥操作手术显著提升。ARISE 系统不仅解决了玻璃体视网膜手术中精度不足、一致性差等关键问题,更为显微手术的自主化发展提供了完整的技术方案和实践范式。
随着技术的持续优化和临床验证的深入推进,自主手术机器人有望成为眼科精准医疗的临床装备,为全球数十亿眼疾患者带来更安全、更高效、更可及的治疗方案。同时,该研究的技术成果和研发思路,将为整个医疗机器人领域的发展提供重要借鉴,推动自主医疗技术在更多疾病治疗中的应用,开启精准医疗的新篇章。
本文相关文献:
Gui-Bin Bian et al. ,Autonomous robotic intraocular surgery for targeted retinal injections.Sci. Robot.11,eadx7359(2026).DOI:10.1126/scirobotics.adx7359








