Epioxa 为眼科界及患者提供了首款且唯一经 FDA 批准、无需手术切口、用于治疗圆锥角膜的局部药物疗法。该疗法是针对这一威胁视力的罕见病患者的创新突破性疗法,预计于 2026 年第一季度正式商业化上市。
01 临床背景
全球有超过 2370 万人受到圆锥角膜(KC)的影响。圆锥角膜是一种可致盲性眼部疾病,特征为角膜进行性变薄和变弱,在 30 岁以下患者中进展往往最为迅速。目前该疾病的漏诊和未治疗情况极为普遍。若未及时治疗,可能导致视功能丧失甚至失明,是美国角膜移植(穿透性角膜移植术)的主要原因之一。约 90% 的圆锥角膜病例为双眼发病,未治疗患者中多达 20% 最终需接受角膜移植。
而传统治疗存在局限,眼镜、隐形眼镜等传统圆锥角膜治疗手段仅能改善视力症状,无法减缓或阻止疾病的根本进展。
02 获批产品与企业背景
Glaukos 公司是一家专注于青光眼、角膜疾病和视网膜疾病新型疗法的眼科制药与医疗技术企业。该公司率先研发出微创青光眼手术(MIGS),作为传统青光眼治疗模式的替代方案,并于 2012 年将首款 MIGS 设备商业化推出。

2024 年,公司启动 iDose® TR 的商业化推广,这是首款可长期作用的前房内手术用药物,旨在为眼内提供 24 小时不间断的青光眼药物治疗,且作用时间可延长。
目前,Glaukos 公司仍在持续研发和推进一系列创新型无滴剂平台技术,致力于显著提升慢性眼病的治疗标准,改善患者疗效。
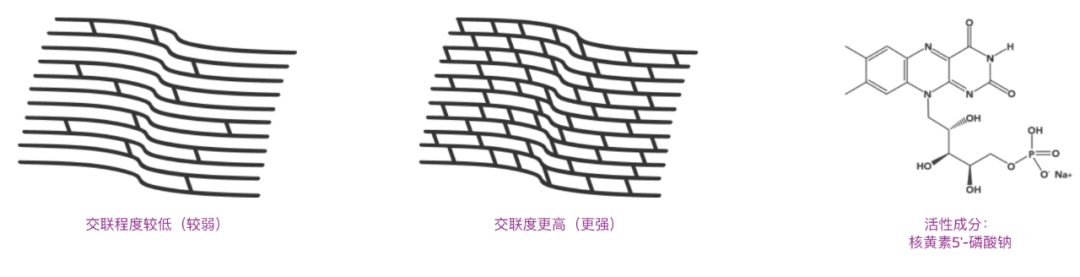
治疗圆锥角膜时,成功的角膜交联术(CXL)需满足三个条件:核黄素使角膜基质饱和、紫外线(UV)照射以及氧气参与。
当核黄素分子体积过大,无法穿透上皮细胞紧密连接,因此传统方法会先去除角膜上皮,再施加核黄素,这种方式被称为上皮去除法(epi-off)。但该方法会导致上皮再生期间患者出现疼痛、角膜混浊,且术后感染风险升高,需通过药物治疗进行严密管理。
Glaukos 第一代 iLink 角膜交联疗法 Photrexa® Viscous/Photrexa® 便是epi-off 法,于 2016 年获美国 FDA 批准为孤儿药,此后一直是首款且唯一经 FDA 批准用于治疗圆锥角膜的角膜交联疗法。目前已有 300 多篇同行评审文献证实该公司交联疗法的疗效与安全性。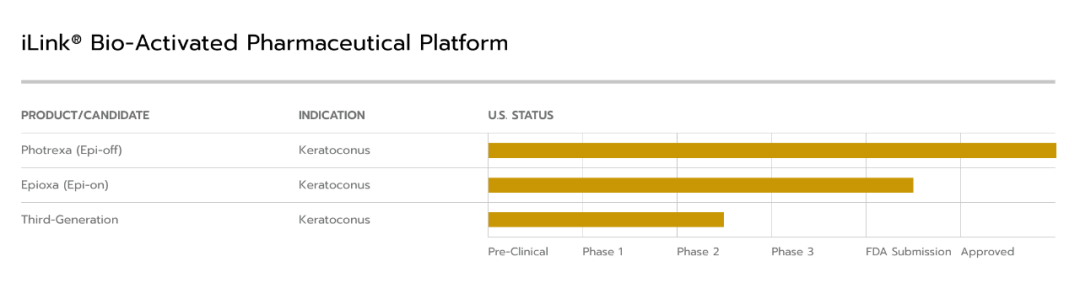
另一种角膜交联术,称之为上皮在位法(epi-on),能减少 epi-off 法上述问题的发生。核黄素可通过离子电渗疗法或渗透促进剂穿透上皮进入基质,但仅依靠这两种方式会导致交联效果欠佳。原因在于,角膜上皮不仅会吸收约 20% 的入射紫外线能量,还会阻碍氧气扩散进入角膜基质。虽然可通过调整照射到基质的紫外线能量密度,来补偿上皮吸收的能量,但弥补基质氧气不足的问题则更为复杂。
Glaukos 通过渗透促进剂、优化的紫外线照射方案以及大气中的氧气,开发的上皮在位法角膜交联术,已能实现与上皮去除法相当的角膜加固效果。
2025年10月20日宣布,其角膜领域第二款管线 Epioxa™ HD/Epioxa™(以下简称 “Epioxa”)新药申请(NDA)已获美国食品药品监督管理局(FDA)批准。Epioxa 是角膜交联领域的突破性进展,这表明,操作简便、效果确切的上皮在位法角膜交联术可以用于临床。
FDA 的批准基于两项前瞻性、随机、多中心、双盲 3 期关键性试验的数据,这两项试验共涉及 400 多名患者。这两项试验均达到了其主要疗效目标,并展现出积极的安全性和耐受性结果。
Epioxa 作为圆锥角膜治疗领域的变革性创新,为传统角膜交联手术提供了无需切口的替代方案,无需移除角膜上皮。这款新型富氧局部治疗药物经紫外线激活,可消除上皮移除带来的疼痛感,简化手术流程,缩短恢复时间。同时,该药物能实现具有临床意义的疗效,为患者、医疗服务提供者和医疗体系带来显著价值。Epioxa 包含两种制剂(Epioxa HD 和 Epioxa),在交联手术过程中需依次给药,随后在富氧环境下通过紫外线激活。
2025年,公司业绩强劲增长,第二季度净销售额同比增长30%,达到1.241亿美元。角膜健康业务销售额为 2060 万美元,同比增长 4%。其中美国青光眼治疗产品为销售额主力产品,季度销售额达到7230万美元。公司将全年业绩预期上调至4.8亿至4.86亿美元。这一增长主要反映了其青光眼产品 iDose TR植入物的强劲应用以及市场渗透率的不断提升。公告发布后,这家纽约证券交易所上市公司的股票于10月20日开盘上涨1.8%,至88.80美元。Glaukos 的市值为50亿美元。
03 行业与企业观点
Glaukos 董事长兼首席执行官 Thomas Burns 表示:“Epioxa 获 FDA 批准,为圆锥角膜患者带来了新的治疗标准。它是首款无需移除角膜上皮、经 FDA 批准的局部药物疗法,能显著提升患者舒适度并缩短恢复时间,是圆锥角膜治疗领域的颠覆性新方案。感谢临床试验中的研究人员和参与者,他们为这一重要进展发挥了关键作用。此次获批是公司‘改善患者获取保视疗法渠道’使命中的重要里程碑,我们很高兴能将这一变革性疗法推向市场,造福患者。”亚特兰大眼科顾问公司角膜专家、角膜学会主席 W. Barry Lee 医学博士指出:“圆锥角膜目前存在漏诊和治疗不足的问题。即使幸运地被确诊,现有标准治疗方案仍需移除角膜上皮。当前手术带来的疼痛和漫长愈合时间,是患者接受治疗的主要障碍。Epioxa 作为无需切口、无需移除上皮的治疗方案,我认为它能解决这两大核心问题。”随着此次获批,公司计划在患者认知和治疗可及性方面投入大量资源,同时解决这一罕见病患者群体长期面临的漏诊和治疗不足问题。这些举措将覆盖患者诊疗全流程(从疾病认知到诊断再到治疗),为患者及家属提供支持,具体包括:简化患者治疗获取支持计划、推出降低经济负担的共付援助计划、制定以医疗专业人员(HCP)和患者为中心的综合策略以加强教育与参与度、开展广泛的认知与检测项目以推动疾病的早期筛查和诊断。
附Epioxa HD/Epioxa 适应证及重要安全信息
适应证
EPIOXA™ HD(核黄素 5'- 磷酸眼用溶液)0.239% 和 EPIOXA™(核黄素 5'- 磷酸眼用溶液)0.177% 为光增强剂,适用于成人及 13 岁及以上儿童患者圆锥角膜的上皮保留型角膜胶原交联治疗,需与 O2n™系统和 Boost Goggles® 配合使用。
剂量与用法
Epioxa HD 和 Epioxa 为局部眼用制剂,不可注射或眼内使用。
产品采用单剂量注射器包装,开启后需立即丢弃,不可重复使用。
仅可与 O2n 系统和 Boost Goggles 配合使用,具体设备操作请参考 O2n 系统操作手册和 Boost Goggles 用户指南。
禁忌症
对苯扎氯铵或 Epioxa HD、Epioxa 中任何成分过敏的患者禁用。
无紫外线阻断人工晶状体的无晶状体眼和人工晶状体眼患者,禁用上皮保留型角膜胶原交联治疗。
警告与注意事项
有疱疹性角膜炎病史的患者使用角膜胶原交联治疗时需谨慎,因该治疗可能导致疱疹性角膜炎复发。
不良反应
最常见的不良反应为结膜充血(发生率 31%)。
发生率在 5% 至 25% 之间的其他不良反应包括:角膜混浊( haze)、畏光、点状角膜炎、眼痛、眼部刺激、流泪增多、角膜上皮缺损、眼睑水肿、角膜条纹、视力下降、干眼症和前房闪辉。








